ADC药物火爆背后的CDMO需求
来源:医药魔方
早在1913年,诺贝尔奖获得者、德国免疫学家欧里希(Paul Ehrlich)率先提出了“Magic Bullets”的设想:如果将毒性药物(也就是子弹头)安装在特异性靶向肿瘤细胞的载体上,便可能实现在不伤害正常细胞的前提下精确杀死癌细胞。然而,这一设想远远超出了当时的技术能力。
直到1975年,来自英国和德国的两位生物学家Cesar Milstein和Georges Kohler首次制备得到单克隆抗体,才使得这一设想距离成为现实迈出了一大步。此后,随着单抗技术的进步,经过科学家们的不懈努力,全球第一个抗体偶联药物(antibody-drug conjugate,ADC)终于在2000年应运而生。
ADC由抗体、细胞毒药物、连接子三部分组成。理想状态下,当ADC进入体内循环系统后,抗体识别肿瘤细胞表面的抗原表位并与之结合,肿瘤细胞将ADC吞噬,之后在细胞内被溶酶体降解,细胞毒药物释放从而杀死肿瘤细胞。如果将抗体偶联药物比作核导弹,那么抗体就相当于导弹,而细胞毒药物就是核弹头。
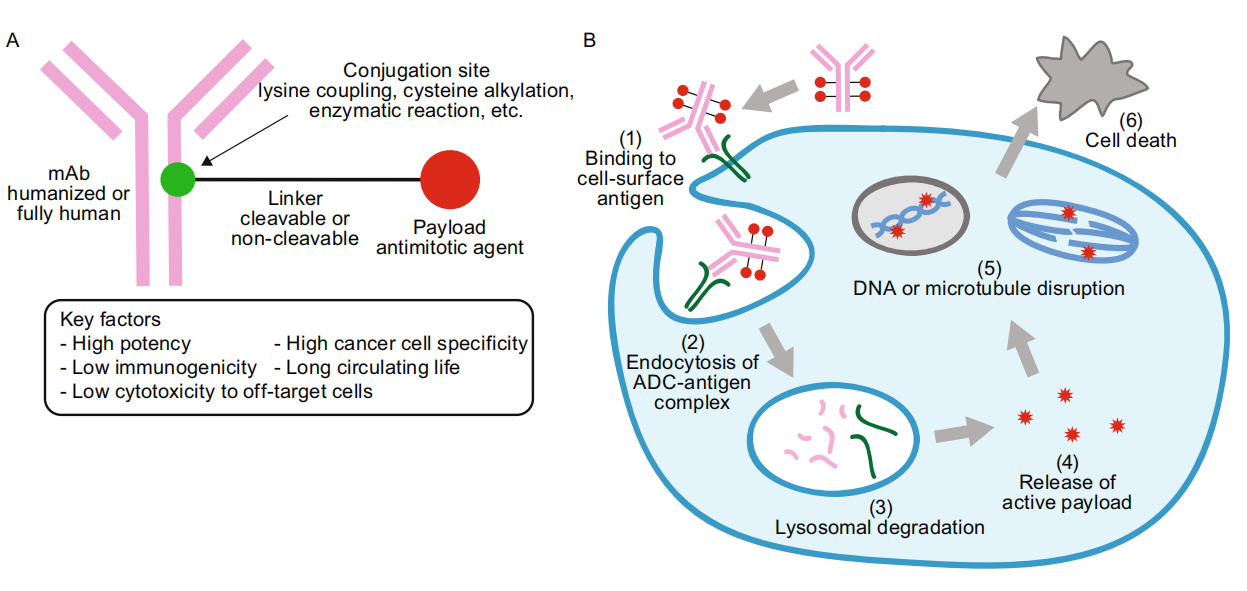
ADC药物的结构和作用机制(来源:Protein Cell 2018, 9(1):33–46)
ADC赛道火爆
与肿瘤免疫疗法相比,ADC药物不算是新生事物,但是首个ADC药物Mylotarg上市之后,由于毒性问题和获益不够突出在2007年撤市,这让ADC赛道在之后的10年陷入了沉寂期,Kadcyla(罗氏)、Adcetris(Seagen)成为这10年为数不多的亮点。
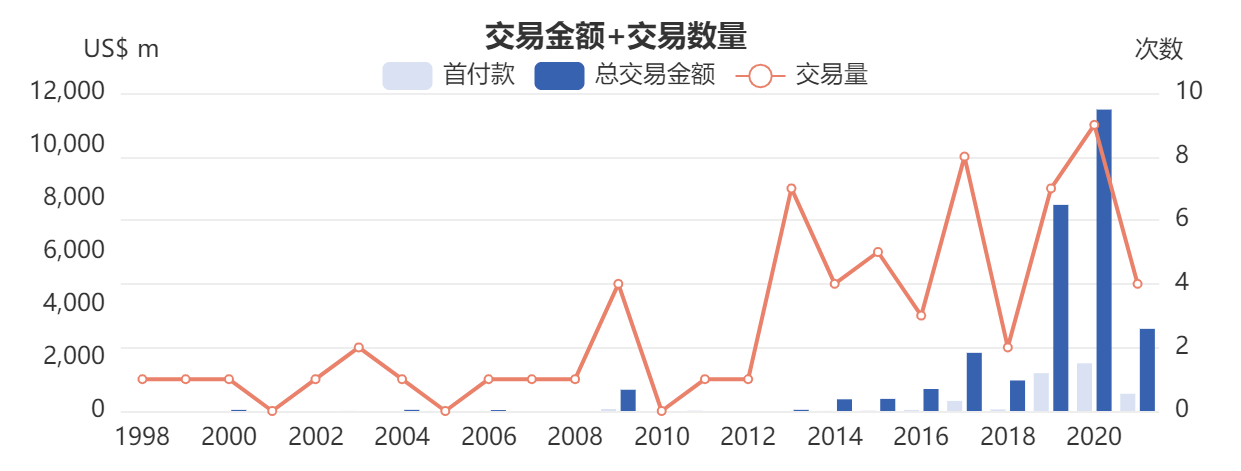
一直到2017年,Mylotarg重新上市,加上FDA批准首个CD22 ADC新药上市,让ADC赛道再次回暖。2019年,FDA紧跟着又批准了3款ADC新药,除了大名鼎鼎的DS8201之外,另外两个都是靶向CD79b、Nectin-4的新靶点ADC,彻底激发了行业对ADC药物的投资研发热情,一系列数十亿美元、上百亿美元的交易频繁发生,小规模的ADC项目交易更是数不胜数。
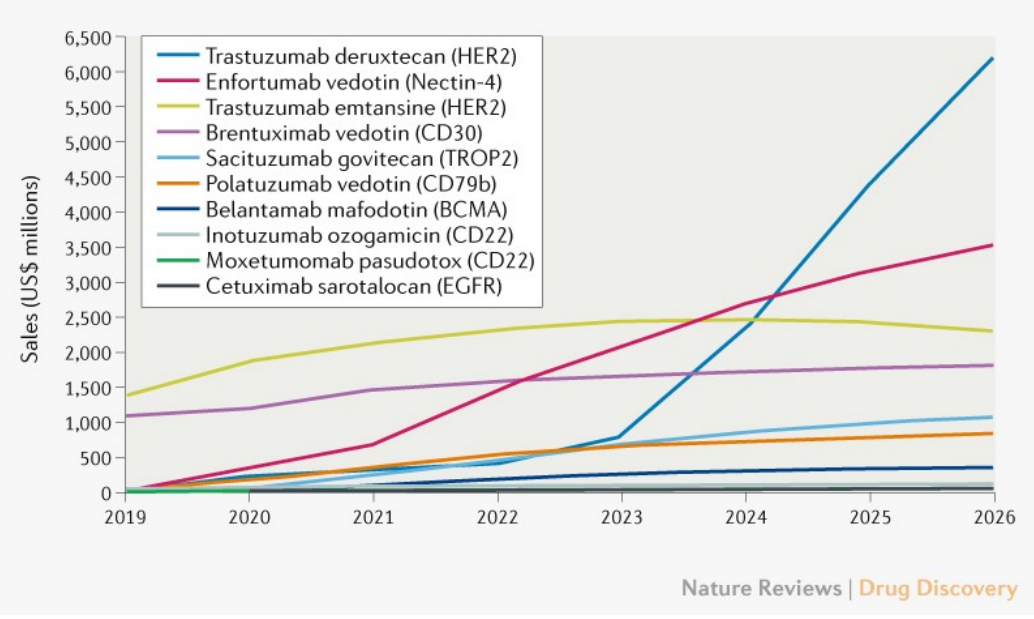
2021年3月,Nature Reviews Drug Discovery对于10个已经批准上市的ADC药物进行了销售预测:到2026年预计将超过164亿美元,最重磅的产品来自阿斯利康/第一三共联合研发的Enhertu(trastuzumab deruxtecan),预计在2026年销售额将达到62亿美元。
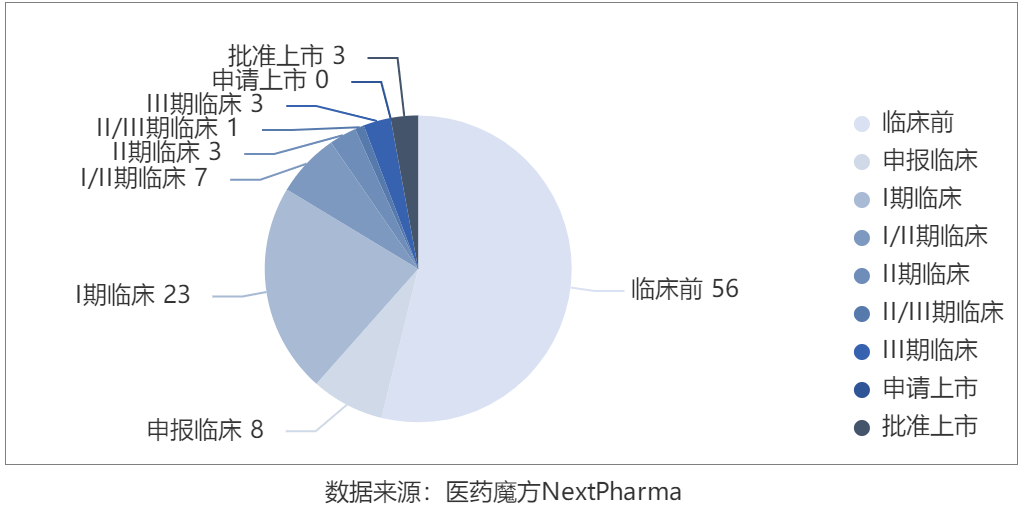
无论是从全球ADC药物管线储备上,还是市场空间预测和想象力上,ADC药物可以说已经是时下最热门的赛道之一。截止目前,全球披露的ADC项目达到339个,中国公司的项目有104个,占比30%;全球已上市的ADC药物共13个,包括荣昌生物的维迪西妥单抗在2021年6月获得NMPA批准,是首个上市的国产ADC药物。
中国公司相关ADC项目全景
随着更多新靶点ADC药物获批上市,ADC赛道的开发竞争已经开启新篇章。一方面,越来越多的同类靶点ADC进入临床或者向临床后期推进,差异化的适应症开发策略和临床设计决定了ADC项目的商业化成败。另一方面,越来越多的ADC项目进入临床开发后期或者即将提交上市申请,大规模商业化生产成为企业需要提前考虑和布局的问题。
鉴于ADC药物的特殊性,无论是自建还是外包,形成完备的商业化生产能力并非一朝一夕,也不是一点一面。为了有效合理推进产品开发和上市计划,商业化生产能力必须尽早布局,而选择CDMO合作伙伴也是当前市场环境下的重要策略。但,要想找到一家与自身项目匹配的CDMO伙伴并非易事。
ADC药物的商业化生产难点
第一个难点是多场地管理。
ADC是一种三元复合物形成的单一分子,涉及抗体、连接子和毒素三部分。其中抗体通常采用CHO细胞发酵所得,连接子是化学合成,而毒素有些是直接化学合成,有些是天然来源经提取后得到起始物料再经化学合成得到。这就涉及到三种不同生产车间,所需技术能力也各不相同,因此通常是在多个场地分别生产,这在法规上也是允许的。在某种程度上来说,生产一个ADC药物相当于生产三个药物的工作量。
其实,不仅仅是工作量,更大的挑战是多场地带来的生产过程的合规性和供应链管理。ADC药物的每个部分,包括抗体、连接子和毒素,以及连接子毒素和生物偶联的生产过程都必须严格按照GMP规范执行。每个部分在不同场地之间的转移,包括出厂、运输过程和进厂,则要求企业建立完善的供应链体系,同时还需要做好在转运过程中的质量监控。
第二个难点是生物偶联技术。
生产ADC药物的核心工作就的将三者偶联到一起形成单一分子。如果说将连接子和毒素相接属于合成反应,相对容易些,而连接子与抗体进行偶联反应是将化学小分子和生物大分子相接,这项工作就有挑战了。
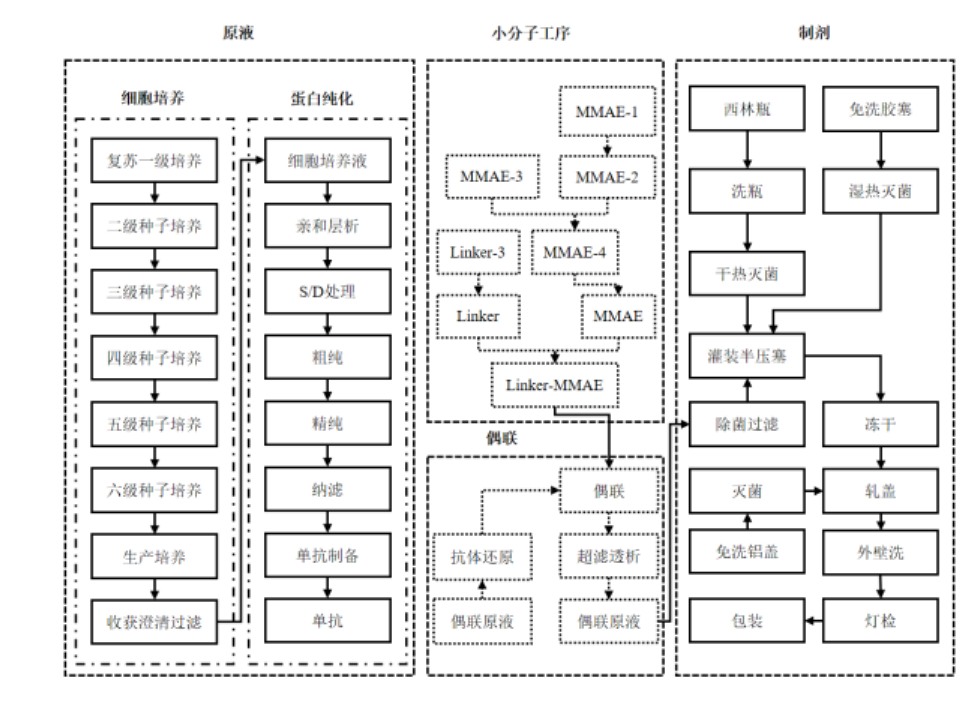
ADC生产流程(来源:荣昌生物招股书)
抗体上所连接的毒素数量(DAR)决定了药品的均一性。在传统ADC药物的设计中,连接位点常选择赖氨酸或半胱氨酸。但由于每个抗体上均拥有数个至数十个氨基酸位点,如抗体上80个赖氨酸中有大约30个可以供连接,导致在传统方法下,毒素药物的连接难以准确控制,产出的ADC药物均一性较差,包含除了目标ADC之外,还有裸抗、连接子毒素、DAR过高和过低的ADC的混合物,影响全身毒性暴露,存在安全性风险。
全球第一个批准上市的ADC药物Mylotarg(gemtuzumab ozogamicin)约50%抗体载有4~6个毒素分子,剩余约50%抗体不载有毒素。由于当时偶联技术无法做到每个单抗上面连接恒定数量的毒素分子,使得给患者带来的疗效和安全性不可控,出于临床使用上风险获益的考虑,辉瑞在2010年主动撤市。
经过数十年的发展,定点定量偶联技术也越发成熟,同时在纯化工艺中也会将不合格的副产物剔除,并且还开发偶联检测技术,分析DAR值、药物载药量分布、偶联位点和占位率,从而保证产品的均一性,这也是ADC药物生产时有别于其他分子类型的关键点。
第三个难点在于综合技术能力。
ADC药物的生产必须具备整合抗体、小分子毒素、生物偶联三方面能力,需要多领域专家开展合作,进行化学合成,抗体生产与偶联生产的紧密联动。
首先就是分析检测。ADC药物中抗体、连接子和毒素三部分,涵盖抗体生产、毒素与连接子合成、偶联过程和纯化,以及制剂灌装等生产流程,需要配备全面过程控制以及检测放行功能。ADC分析方法的开发和产品表征比传统抗体药物更加复杂。连接子、毒素、偶联类型和过程,以及ADC药物和连接子毒素的稳定性给分析工作带来诸多挑战,工作量往往是传统单抗药物的两倍以上。
最为关键的是工艺偶联和纯化过程,其中偶联反应需要关注反应浓度、投料量、时间、缓冲体系、pH等,尤其是投入小分子毒素的过程必须在隔离器防护下投料,而且这是放热反应,必须做好温度控制,此外还需要监测高分子变异体和游离药物残留;在纯化过程中,应当有效去除偶联反应中工艺相关和制品相关杂质,尤其是游离的毒素、连接子毒素、裸抗和ADC聚合体,确保ADC的均一性和稳定性。
此外还有冻干技术。ADC药物通常是冻干产品。在开发和生产过程中,制剂处方和冻干工艺应当平衡抗体、连接子毒素和偶联化学的稳定性。
由于ADC药物涉及高活性毒素,还有一项重要工作是设施设备清洁管理。如果使用到非一次性设施设备,应当做好清洁验证,杜绝交叉污染。这也是为了产品质量得以保障。
第四个难点在于人员和环境安全防护。
同样是因为高活性毒素,对于人员和环境的安全防护也是重中之重。
从设施设备的布局、房间压差温湿度、房间的排风换气次数、人物流走向、工艺操作流程等因素,确保可以避免污染和交叉污染。此外,还需要根据毒性严重程度进行风险评估,确定药物的职业暴露等级,根据职业暴露等级制定针对性的防护措施,确保人员、环境和产品的安全。但凡涉及到毒素的生产和检测,都应当按照职业暴露高等级进行防护和应急措施。对于涉及毒素的三废处理,也应当建立有效灭活措施,避免对环境造成污染。
由此可见,ADC药物的特性带来技术难度、质量监控和安全防护上的复杂性,使得生产供应链体系造成巨大挑战。这就是ADC药物的现状:研发难,生产也不容易。国内诸多研发ADC药物的企业到后期都不得不想办法解决商业化生产的问题。
ADC药物CDMO资源稀缺
ADC 药物的生产涉及抗体、高活性毒素、偶联方法和纯化等一系列关键技术,技术难度大、工艺要求高,而且对人员安全须做到严密防护,生产过程全流程严格监控,都造成了ADC药物的生产有着非常高的技术壁垒,这也导致了生产资源的稀缺性。
国内很多ADC药物研发企业选择自建产能,将生物偶联这一步开始到最后的制剂灌装选择在自己车间完成,而抗体、连接子和毒素这些生产工作由外部工厂完成。有些公司会选择将生产工作全部外包,这就需要寻找合适的CDMO资源。盘点下来,其实可供选择的余地并不多。
1. 药明合联
2021年7月19日,药明生物与合全药业联合成立的药明合联(WuXi XDC)在无锡高新区举行开业庆典。合资公司将从事抗体偶联药物(ADC)及其他生物偶联药物的合同开发与生产(CDMO),服务涵盖抗体和其他偶联生物药、连接子/化学有效载荷、偶联原液及制剂等研发和生产领域。
早在三年前,“药明系”就开始筹备药明合联。2018年,药明生物在无锡筹建ADC一体化研发生产中心。2019年,ADC的原液和制剂厂正式投入商业化生产。2021年3月30日,药明生物发布公告计划与合全药业成立合资公司药明合联,分别注资1.2亿美元及8000万美元。
药明合联依托两家母公司的优质资源,形成了自己的独特优势:
地理上,药明合联的大分子和小分子生产基地在无锡和常州,两地相距车程范围1到2小时,降低了生产物资转运过程中可能产生的风险。
技术上,药明生物ADC研究团队开发了创新技术平台“WuXiDAR4TM”,该平台提高了最终ADC产物DAR4 (每个单克隆抗体有4个有效载荷分子)的比例,从而提升偶联效率。合全依托大量毒素分子和连接子资源,为评估连接子/有效载荷物提供了灵活性,不仅可以提供MMAE/F、DM1/DM4、Calicheamicin等常用载荷药物,还可以开发生产各种新型载荷药物以及基于寡核苷酸和多肽的偶联化合物。
硬件上,位于无锡生物偶联生产园区可以处理OEB-5的有毒负载,将进一步扩大到包括500 L生物反应器和一个20平方米冻干机。位于上海金山以及江苏常州的合全原料药及中间体研发生产基地拥有高活原料药工艺研发实验室、公斤级cGMP实验室以及cGMP生产车间,具有10多个1L-1,000L不同规模的反应釜,能够生产OEL低至10ng/m³的高活化合物。
经验上,药明生物在缩短ADC开发时间方面处于行业领先地位,成功地在15个月或更短的时间内将多个ADC项目引入IND申请阶段,几乎将传统的开发时间缩短了一半。随着药明合联的成立,药明生物会将旗下正在推进中的40多个ADC项目全部转入药明合联,这其中还包括1个即将进入商业化的Ⅲ期临床项目。
2. 迈百瑞
2021年6月,荣昌生物ADC产品RC48获批上市,迈百瑞作为荣昌生物的子公司,在ADC领域的优势不言自明。
烟台迈百瑞国际生物医药有限公司由烟台荣昌制药股份有限公司、烟台开发区管委、同济大学等于2013年共同发起成立,在烟台、上海、美国圣地亚哥三个研发及生产中心,提供抗体类药物和ADC等创新药的研发和生产服务。在ADC方面,迈百瑞主要提供连接子-毒素设计合成、偶联工艺开发、分析方法开发以及商业化生产等服务。
技术上,迈百瑞拥有自主知识产权的连接子技术,能够改善治疗窗口并降低非特异性细胞毒性,加快ADC药物的开发过程。
硬件上,迈百瑞ADC药物的偶联规模达150L;小分子生产工艺平台可提供50g级小分子生产,10L-150L规模偶联反应釜及相配套的纯化、冻干粉针剂生产设备。据了解,为更好满足客户需求,其连接子毒素合成车间正在进行升级改造,改造后的车间可提供400g级连接子毒素(基于MMAE)商业化生产,以帮助客户控制ADC生产成本。
经验上,迈百瑞从2015年开始GMP运营至今,经历了100多个新药项目,其中ADC约占20%。值得一提的是,中国目前唯一上市的ADC产品RC48就来自于迈百瑞母公司荣昌生物。
3. 东曜药业
同样是在7月19日,东曜药业宣布与博瑞医药建立伙伴关系,开展抗体偶联药物(ADC)CDMO服务战略合作。
东曜药业成立于2009年,拥有集单抗及ADC药物于一体的研发及产业化平台。其自主研发的ADC产品TAA013已经进入III期临床,依托该产品的开发,东曜药业建立起一整套先进的ADC技术平台和商业化生产平台。伴随着ADC的爆发,东曜药业顺势迈入ADC产品的CDMO赛道。
地理上,东曜药业在同一厂区内建立了抗体CMC生产平台,OEB-5级别的小分子药物的生产车间和GMP标准的生物偶联车间,减少多个供应商分段式外包带来的管理、运输和技术风险,节约了研发和生产的时间。此外,根据东曜药业和博瑞医药签署的战略协议,博瑞将补足ADC连接子以及毒素等中间体开发的环节,从而实现“一站式”交付。由于两家公司均位于苏州工业园区,相距不到10公里,进一步避免了ADC研发和生产带来的跨区域监管的风险,并且提升了商业化效率。
技术上,东曜药业拥有核心偶联工艺和放大的技术优势,具备ADC关键质量属性的自主分析能力,建立了完整的ADC分析技术平台。
硬件上,东曜药业拥有OEB-5级别的ADC中试车间,以及符合GMP标准的集ADC原液、制剂和单抗于一体的完整的ADC商业化生产车间。
经验上,东曜药业同样拥有从研发、工艺开发、临床试验、注册报批到商业化生产的全流程经验,特别是中、美成功申报,可以支持客户顺利进行申报。
4. 臻皓生物
荣昌生物RC48的上市提振了ADC开发的信心,也凝聚了多家企业的心血,其中也包括皓元医药,皓元为RC48贡献了毒素。
6月,皓元医药联手臻格生物,设立臻皓生物,合力打造抗体偶联药物 (ADC) 研发与中试生产一站式服务平台。臻皓充分整合了臻格、皓元在各自大分子、小分子 CDMO 领域的上下游优势资源,成为了ADC CDMO的新成员。
地理上,臻皓生物在上海浦东新区50公里范围内建立了供应链生态。其中,臻皓生物在临港智造园的研发和生产基地预计于年底完工,而臻格也位于浦东临港,皓元则在浦东张江。
技术上,臻皓生物在工艺开发和偶联技术上具备优势。除了拥有赖氨酸和半胱氨酸偶联工艺方法开发技术,臻皓还引进了国际新型专利偶联技术,如ThiomAbTM定点偶联、非天然氨基酸定点偶联、各种酶催化定点偶联以及多聚糖偶联等。
硬件上,臻皓生物在临港智造园六期投入1亿多人民币建设的 6,400 平米研发和 GMP 生产一体化服务平台,将于今年年底完工。目前,臻皓已经开展ADC药物筛选、偶联纯化小试工艺开发优化以及分析方法开发及制剂冻干工艺开发等服务项目。
结语
ADC的热潮绝非偶然,它建立在不断技术迭代更新基础上。新的ADC构造方法学,诸如新型连接子和更多的有效载荷技术,层出不穷。新的连接子,新的毒素,新的靶点,新的偶联技术,近2年也看到了各种天马行空的偶联药物概念,以及技术上的创新也给ADC的生产带来巨大的挑战。
ADC药物本身的复杂性对研发、制备和生产工艺都提出了极高的要求,GMP管理,供应链管理以及安全防护管理也都带来极大挑战,药物在研发及放大生产过程中存在的风险和挑战显露无疑。ADC药物开发者们把目光转向CDMO。
目前,70%-80%的ADC药物开发生产会采用合同研发生产组织(CDMO)形式进行。ADC药物开发者们希望利用CDMO的平台优势和生产经验,加快实现从实验室到患者的进程,解决ADC药物在生产上的各种挑战。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
免责声明:本网站内容主要来自原创、合作媒体供稿和第三方自媒体作者投稿,凡在本网站出现的信息,均仅供参考。本网站将尽力确保所提供信息的准确性及可靠性,但不保证有关资料的准确性及可靠性,读者在使用前请进一步核实,并对任何自主决定的行为负责。本网站对有关资料所引致的错误、不确或遗漏,概不负任何法律责任。任何单位或个人认为本网站中的网页或链接内容可能涉嫌侵犯其知识产权或存在不实内容时,应及时向本网站提出书面权利通知或不实情况说明,并提供身份证明、权属证明及详细侵权或不实情况证明。本网站在收到上述法律文件后,将会依法尽快联系相关文章源头核实,沟通删除相关内容或断开相关链接。
资讯排行榜
-
2021-07-26 09:48
-
2018-09-29 14:02
-
2018-09-29 14:04
-
2018-09-29 14:09
-
2018-09-30 09:15
资讯热门推荐
-
2021-07-26 09:48
-
2018-09-29 14:02
-
2018-09-29 14:04
-
2018-09-29 14:09
-
2018-09-30 09:15


















